Fenolftaleină
| Fenolftaleină | |
 | |
 | |
| Denumiri | |
|---|---|
| Identificare | |
| Număr CAS | 77-09-8 |
| ChEMBL | CHEMBL63857 |
| PubChem CID | 4764 |
| Informații generale | |
| Formulă chimică | C20H14O4 |
| Masă molară | 318.33 g/mol |
| Proprietăți | |
| Densitate | 1.299 g/cm3 |
| Starea de agregare | solid |
| Punct de topire | 263-265 °C |
| Punct de fierbere | 258 °C |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Fenolftaleina este o substanță chimică care se prezintă sub formă de cristale albe incolore, solubile în alcooli (metanol, etanol, propanol, izopropanol etc.) și mai puțin solubile în apă. Se folosește, în special, ca indicator de pH la titrări. În trecut era folosit în medicină ca purgativ/laxativ și ca indicator de hemoglobină (testul Kastle-Meyer).
| Fenolftaleină (indicator pH) | ||
| sub pH 8,2 | peste pH 10,0 | |
| 8,2 | ⇌ | 10,0 |
Sinteză
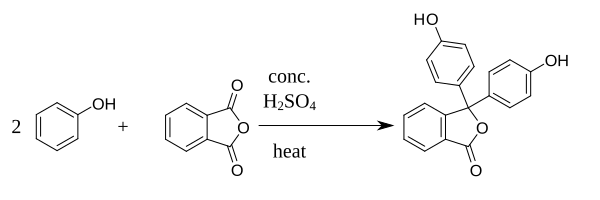
[modificare | modificare sursă]Fenolftaleina poate fi sintetizată prin condensarea anhidridei ftalice cu două molecule de fenol în prezență de H2SO4 concentrat.[2] Reacția poate fi catalizată și de un amestec de clorură de zinc și clorură de tionil.[3]
Culoare
[modificare | modificare sursă]În mediu acid există sub forma lactonică cu carbonul scheletului triarilmetanic hibridizat sp3, cu electronii neparticipanți la conjugarea cu nucleele aromatice.Sub acțiunea soluțiilor alcaline are loc transformarea în sare disodică , de culoare roșie, cu structură chinonică. Carbonul este hibridizat sp2, ca urmare are loc o conjugare cu nucleele aromatice, conjugarea asigurând astfel stabilitatea culorii.Excesul de soluție puternic alcalină determină distrugerea structurii și dispariția culorii. În această etapă, fenolftaleina trece în structura carbinolică (deoarece se obține un alcool numit carbinol) și se revine la hibridizarea sp3 a carbonului central.
| Formele indicatorului | In |
H2In |
In2− |
In(OH)3−
|
|---|---|---|---|---|
| Structură | ||||
| Model |  |
 |

| |
| pH | < 0 |
0−8.2 |
8.2−10.0 |
> 10.0
|
| Condiții | puternic acid |
acid |
alcalin |
puternic alcalin
|
| Culoare | portocaliu |
incolor |
roz |
incolor
|
| Foto |  |
 |
Utilizare
[modificare | modificare sursă]- Medicină ca laxativ, actualmente nu se mai utilizează datorită potențialului cancerigen
- Testul Kastle-Meyer pentru evidențierea sângelui.
- În titrimetrie , alături de derivații săi: Eozina, Timolftaleina, Fluoresceină
Note
[modificare | modificare sursă]- ^ „Fenolftaleină”, phenolphthalein (în engleză), PubChem, accesat în
- ^ en „US2192485A - Process of producing phenolphthalein”.
- ^ en „US2522939A - Process for the production of phenolphthalein”.
Bibliografie
[modificare | modificare sursă]- Aplicații și probleme de chimie analitică Croitoru Vasilica, D.A.Constantinescu, Editura Tehnică, 1979
- Chimie organică Mircea Iovu, Editura Didactică și Pedagogică, București, 1982, pag. 273 și 545



