4月15日,认监委官网发布口罩等防疫用品出口欧盟准入信息指南(第二版)。

一、CE标志制度
CE标志制度是欧盟对产品进入欧盟市场进行的监管方式。加贴CE标志的产品表明产品符合欧盟有关安全、健康、环保等法规要求,可以在欧盟27个成员国、欧洲贸易自由区的4个国家、以及英国和土耳其合法上市销售。按照欧盟规定,不同产品采用不同的评价方式加贴CE标志,主要有两种方式:绝大部分产品是制造商采取自我符合性声明方式,就可以加贴CE标志;部分风险相对更高的产品需要经过欧盟授权的第三方机构,即公告机构(Notified Body)进行符合性评定后,方可加贴CE标志。产品经公告机构符合性评定后加贴CE标志的流程:产品制造商向公告机构提出申请,公告机构为制造商提供符合性评定服务,制造商及产品符合法规要求的,向制造商发放CE证书。制造商依据CE证书签署符合性声明,产品加贴CE标志后就可以进入欧盟市场。下表列举了欧盟、成员国的主管当局、公告机构和制造商的职责。
|
角色 |
职责 |
|
欧盟 (EU) |
制定欧盟法规(指令)、协调各成员国的活动。 |
|
成员国主管当局 |
负责对应法规(指令)在本国的执行、联合欧盟对公告机构进行授权,监督公告机构行为,并进行产品的上市后监督。 |
|
公告机构 (NB) |
进行符合性审核,发放CE证书。 |
|
制造商 Manufacturer |
确保自己的产品满足欧盟法规(指令)的要求,进行自我声明或者申请公告机构符合性评定,加贴CE标志,并对产品质量安全负责。 |
口罩在欧盟根据预期用途的不同,分为医用口罩和个人防护口罩两种,分别归属医疗器械条例EU2017/745(MDR)或医疗器械指令93/42/EEC(MDD)和个人防护设备条例EU2016/425(PPE)进行管理。如何判定具体产品属于哪一种口罩,需参照对应的法规规定和标准要求。
|
中国 |
欧盟 |
|
日常防护性口罩 GB/T32610-2016 |
个人防护口罩EN 149:2001+A1:2009 Respiratory protective devices; 分为FFP1, FFP2 and FFP3三类 |
|
呼吸防护口罩GB 2626-2006;过滤效率分为三级KN90 (90%),KN95 (95%),KN100(99.97%) |
|
|
医用防护口罩GB19083-2010;过滤效率1, 2, 3级:95%,99%,99.97% |
医用口罩 EN 14683:2019 Medical face masks;分为Type I (95%),Type II (98%),Type IIR (98%). * (EN 14683:2005 名称是手术口罩Surgical masks) |
|
医用外科口罩YY 0469-2011 |
|
|
一次性使用医用口罩 YY/T0969-2013 |
1.技术文件要求:
参照MDR法规附录II和附录III的要求(MDD为附录7),技术文件通常包括以下七个部分: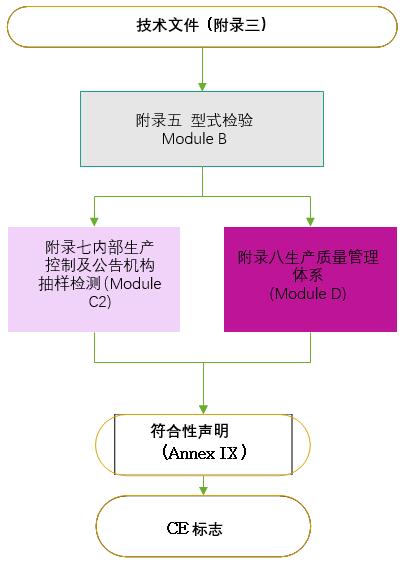
|
口罩类别 |
医用非灭菌口罩 |
医用灭菌口罩 |
个人防护口罩 |
|
用途 |
在医疗环境中佩戴以保护病人,或者由病人佩戴,防止疾病传播 |
在手术环境或类似的医疗环境中佩戴以保护病人或者环境,防止疾病传播 |
个人佩戴以保护该人员的健康和安全,免除对应的风险 |
|
适用法规 |
MDR法规或MDD指令 |
MDR法规或MDD指令 |
PPE法规 |
|
分类 |
I类非灭菌 |
I类灭菌- Class Is |
III类 |
|
主要适用标准 |
EN 14683 |
EN 14683 + 灭菌标准 |
EN 149 |
|
技术文件 |
需要 |
需要 |
需要 |
|
体系要求 |
售后监督要求 |
需要 |
需要 |
|
符合性评定途径 |
自我声明 |
公告机构评定 |
公告机构评定 |
|
CE证书 |
不需要 |
一张 |
两张 |
|
符合性声明 |
需要(在确保产品安全有效符合法规要求后签署) |
需要(在获取CE证书后签署) |
需要(在获取CE证书后签署) |
|
CE标志 |
需要 |
需要(CE +四位数的公告机构号码) |
需要(CE +四位数的公告机构号码) |